Neurogene Detrusorüberaktivität
Die Läsion kann im Zusammenhang stehen mit u.a.
- einer angeborenen Erkrankung, z. B. Myelomeningozele,
- einem erworbenen, stabilen Zustand, z. B. einer Rückenmarksverletzung, einem Schlaganfall, oder
- einer erworbenen, fortschreitenden Erkrankung, z. B. Multiple Sklerose, Demenz oder Parkinson.
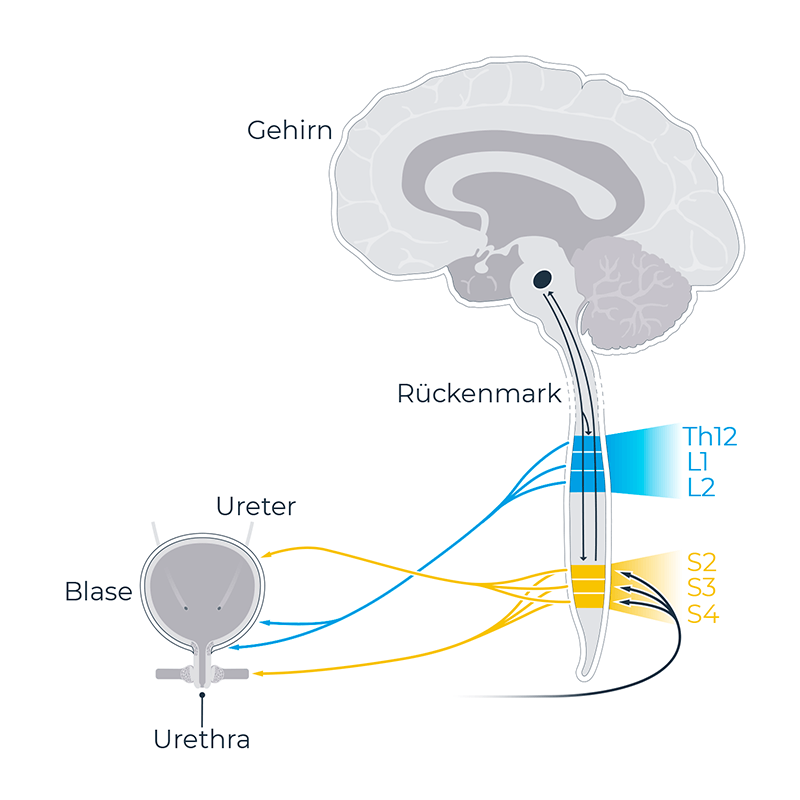
Die Art einer Blasenfunktionsstörung hängt von der Lokalisation, der Ausdehnung und der Veränderung im Verlauf ab.
Bei suprapontinen Läsionen bleibt der Miktionsreflex erhalten, allerdings kann die Blasenfunktion nicht mehr kontrolliert werden. Bei einer Rückenmarksverletzung im Bereich des pontinen Miktionszentrums, können Störungen des Miktionsreflexes und ein Verlust der Kontrollfunktion vorliegen. Eine Läsion im subsakralen Bereich oder im Bereich der peripheren Nerven führen zu einer Detrusorhypo- oder -atonie.
Wenn die Läsion im suprasakralen Teil vorliegt, kann eine Detrusor-Sphinkter-Dyssynergie vorliegen. Diese Störung der mangelnden Koordination der Blasenmuskulatur und des Schließmuskels führt zu einer spastischen Kontraktion des äußeren Sphinkters, während sich gleichzeitig der Detrusormuskel kontrahiert. Die Folge ist eine beeinträchtigte Blasenentleerung und erhöhter Restharn. Als Folge können verlängerte und zu starke Detrusorkontraktionen, eine strukturelle Blasenschädigung und ein vesiko-ureteraler Reflux auftreten. Ein erhöhter Blasendruck und Harnwegsinfektionen stellen ein Risiko für die Schädigung der oberen Harnwege dar.
Patient*innengruppe einer NDO im Überblick
Grunderkrankungen mit Beeinträchtigungen der Blasenfunktion u.a.:
![]()
Angeborene Erkrankungen, z. B.:
➤ Spina bifida
Ca. 3–4 Neugeborene jährlich/10.000 Geburten weltweit2
![]()
Erworbene, stabile Zustände, z. B.:
➤ Rückenmarksverletzung
Ca. 1.000 Menschen mit Querschnittlähmung/Mio. Einwohner in Deutschland (2015)5
➤ Schlaganfall
NDO bei 50–80 % der Patient*innen mit Symptomen des unteren Harntraktes4
![]()
➤ Multiple Sklerose
NDO oder DSD bei über 80 % der Patient*innen5, 6
➤ Morbus Parkinson
NDO bei 36–81 % der Patient*innen7-12
![]()
➤ Diabetes mellitus
Somatische Neuropathie bei 50 % der Patient*innen, davon 75–100 % mit NLUTD13, 14
Indikation
VESOXX® (1 mg/ml) wird angewendet zur Unterdrückung einer neurogenen Detrusorüberaktivität (Neurogenic Detrusor Overactivity; NDO) bei Kindern ab 6 Jahren und bei Erwachsenen, die ihre Blase mittels sauberer intermittierender Katheterisierung (CIC) entleeren, wenn sie durch eine Behandlung mit oralen Anticholinergika aufgrund mangelnder Wirksamkeit und/oder unerträglicher Nebenwirkungen nicht adäquat eingestellt werden können.15
Abgrenzung überaktive Blase
NDO oder iOAB? Ein zweiter Blick lohnt sich!
Der neurogenen Detrusorüberaktivität liegt eine neurologische Grunderkrankung zugrunde.
| NDO16-18 | iOAB19,20 | |
|---|---|---|
| Entstehung |
|
|
| Symptome/ Komplikationen |
|
|
| Therapieziele |
|
|
VESOXX® als 2. Linientherapieoption gemäß europäischer und nationaler Leitlinien2, 18, 21, 22
Orale Anticholinerika
Erwachsene:
Oxybutynin, Propiverin und Trospiumchlorid
Kinder:
Oxybutynin, Propiverin und Solifenacin
Dosiseskalation und Kombinationstherapie## möglich
2. Linientherapie
die intravesikale Lösung zur Behandlung der neurogenen Detrusorüberaktivität1
Kombinationstherapie## möglich
3. Linientherapie#
Minimalinvasive Verfahren
Intramuskuläre Injektion von Botulinumtoxin in den Detrusor
4. Linientherapie
Invasive Verfahren
Operative Eingriffe, u. a. am Blasenhals und der Harnröhre
(Quelle: FARCO-Pharma GmbH)
# Bei Versagen der antimuskarinergen Therapie kann das s3-Sympathomimetikum Mirabegron eingesetzt werden (nicht zugelassen fur die NDO).
## z.T. nicht fur die NDO zugelassene Therapien.
Weiterführende Informationen zu dem Schema
2. Linientherapie
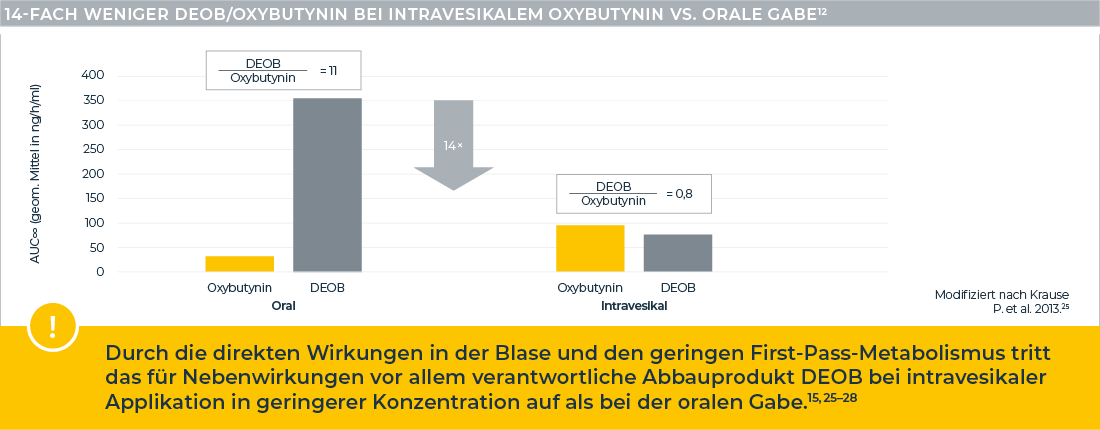
Vorteile der intravesikalen Therapie mit VESOXX®15

Vorteile der intravesikalen Therapie mit VESOXX®15

3. Linientherapie
VESOXX® als Option für eine Kombinationstherapie mit Botulinumtoxin
VESOXX®
- als Option für den Einsatz bei Non- und Poor-Respondern
- zur Senkung des Detrusordrucks für eine verbesserte Kontinenz
- lässt sich einfach in die ISK-Routine integrieren
- für eine patientenindividuelle Nachsteuerung
- kann als Möglichkeit zur Verlängerung der Botunlinumtoxin-Intervalle eingesetzt werden
- Trepel M., Urban & Fischer Verlag/Elsevier GmbH. 2008; 4. Auflage.
- Blok B. et al., EAU Guidelines on Neuro-Urology. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2020. ISBN 978-94-92671-07-3.
- Thietje R., Hirschfeld S., Aufenthaltsdauer, in Strubreither W (ed): Klinische Psychologie bei Querschnittlähmung: Psychologische und psychotherapeutische Interventionen bei psychischen, somatischen und psychosozialen Folgen, Wien, Springer, 2015; 53–8.
- Linsenmeyer T.A. and Zorowitz R.D., Urodynamic findings in patients with urinary incontinence after cerebrovascular accident. Neuro Rehabil. 1992; 2:23–6.
- Hemmer B. et al., Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis optica Spektrum Erkrankungen und MOG IgG assoziierten Erkrankungen, S2k Leitlinie, 2021, in: Deutsche Gesellschaft für Neurologie Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie.
- Feneberg W. and König N., Value of urodynamics in multiple sclerosis. J Neurol, 2000. 247(Suppl 3):III/171.
- Ragab M. M. and Mohammed E. S., Idiopathic Parkinson‘s disease patients at the urologic clinic. Neurourol Urodyn. 2011;30(7):1258–1261.
- Bonnet A. M. et al., Urinary disturbances in striatonigral degeneration and Parkinson‘s disease: clinical and urodynamic aspects. Mov Disord. 1997; 12(4):509–513.
- Campos-Sousa R. N. et al., Urinary dysfunction with detrusor hyperactivity in women with Parkinson‘s disease cannot be blamed as a factor of worsening motor performance. Arq Neuropsiquiatr. 2013; 71(9A):591–595.
- Sakakibara R. et al, Videourodynamic and sphincter motor unit potential analyses in Parkinson‘s disease and multiple system atrophy. J Neurol Neurosurg Psychiatry. 2001;71(5):600-606.
- Araki I. et al., Voiding dysfunction and Parkinson‘s disease: urodynamic abnormalities and urinary symptoms. J Urol. 2000; 164(5):1640–1643.
- Stocchi F. et al., Urodynamic and neurophysiological evaluation in Parkinson‘s disease and multiple system atrophy. J Neurol Neurosurg Psychiatry. 1997; 62(5):507–511.
- Ellenberg M. Development of urinary bladder dysfunction in diabetes mellitus. Ann Intern Med. 1980; 92(2 Pt 2):321–323.
- Frimodt-Møller C., Diabetic cystopathy: epidemiology and related disorders. Ann Intern Med. 1980;92(2 Pt 2):318–321.
- VESOXX® Fachinformation.
- Böthig R. et al., Neuro-urologische Diagnostik und Therapie bei Funktionsstörungen des unteren Harntrakts nach einer Rückenmarkschädigung: S2k-Leitlinie der Deutschsprachigen Medizinischen Gesellschaft für Paraplegie (DMGP), AWMF-Register Nr: 179/001. Update 2021.
- Haensch C.A. et al., Diagnostik und Therapie von neurogenen Blasenstörungen. Deutsche Gesellschaft für Neurologie. 2020. S1-Leitlinie, Leitlinien für Diagnostik und Therapie in der Neurologie.
- Stein R. et al., Diagnostik und Therapie der neurogenen Blasenfunktionsstörungen bei Kindern und Jugendlichen mit spinaler Dysraphie. S2k Leitlinie der AWMF. Update 2019.
- Haylen B. T. et al., An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Int Urogynecol J. 2010; 21(1):5–26.
- Harding C. K. et al., EAU Guidelines on Management of Non-Neurogenic Female Lower Urinary Tract Symptoms. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam March 2022. ISBN 978-94-92671-16-5.
- Arbeitskreis Neuro-Urologie der DMGP, S2k-Leitlinie, Neuro-urologische Versorgung querschnittgelähmter Patienten. AWMF: 179-001. Stand 03/2016.
- Kutzenberger J. et al., Medikamentöse Therapie der neurogenen Dysfunktion des unteren Harntraktes (NLUTD). S2k-Leitlinie, AWMF: 043-053. Stand 02/2022.
- Khanna R. et al., Urodynamic Management of Neurogenic Bladder in Spinal Cord Injury. Med J Armed Forces India. 2009; 65(4):300–304.
- Madhuvrata P. et al., Anticholinergic Drugs for Adult Neurogenic Detrusor Overactivity: A Systematic Review and Meta-analysis. Eur Urol. 2012; 62(5):816–30.
- Krause P. et al., Pharmacokinetics of intravesical versus oral oxybutynin in healthy adults: results of an open-label, randomised, prospective clinical study. J Urol. 2013; 190(5):1791–1797; (prospektive, randomisierte Cross-Over Open-Label-Studie (Periode I und II: orales oder intravesikales Oxybutynin, Periode III: intravesikales Oxybutynin), n = 20).
- Kretschmar M. et al., A Population Pharmacokinetic Model of (R)- and (S-) Oxybutynin and Its Active Metabolites After Oral and Intravesical Administration to Healthy Volunteers. J Clin Pharmacol. 2021; 61(7):961–971; (pharmakokinetische Modellanalyse anhand von Daten der Cross-Over Open-Label-Studie25).
- Buyse G. et al., Intravesical Oxybutynin for neurogenic bladder dysfunction: less systemic side effects due to reduced first pass metabolism. J Urol. 1998; 160(3 Pt 1):892–896; (Vergleichsstudie mit intravesikalem (n = 11) und oralem Oxybutynin (n = 5)).
- Lehtoranta K. et al., Pharmacokinetics, efficacy, and safety of intravesical formulation of oxybutynin in patients with detrusor overactivity. Scand J Urol Nephrol 2002; 36:18–24; (randomisierte, placebokontrollierte, doppelblinde Cross-Over Studie (Periode I und II) mit intravesikalem Oxybutynin, Open-Label Studie (Periode III) mit intravesikalem Oxybutynin, n=9).
- Schröder A. et al., Efficacy, Safety, and Tolerability of Intravesically Administered 0.1 % Oxybutynin Hydrochloride Solution in Adult Patients With Neurogenic Bladder: A Randomized, Prospective, Controlled Multi-Center Trial. Neurourol Urodyn. 2016; 35(5):582–588; (randomisierte, prospektive, aktiv kontrollierte, multizentrische Open-Label-Studie mit intravesikalem Oxybutynin (n = 18) und oralem Oxybutynin (n = 17)).
Symptome eines zu hohen Blasendrucks
| Anzeichen von Blasendysfunktionen bei noch undiagnostizierten Patient*innen | Anzeichen von Blasendysfunktionen bei therapierten Patient*innen mit bekannter NDO |
|---|---|
|
|
| Verweisen Sie Ihre Patient*innen an ein (neuro-)urologisches Zentrum, um das Vorliegen einer NDO überprüfen zu lassen. | Verweisen Sie Ihre Patient*innen an ein (neuro-)urologisches Zentrum, um den Therapieerfolg und die Einstellung der Blase überprüfen zu lassen. |
|
Stellen Sie eines oder mehrere dieser Anzeichen fest, sollten weitere urologische Untersuchungen erfolgen, um mögliche Komplikationen zu identifizieren, wie u. a.:
|
|
- Haylen B. T. et al., An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Int Urogynecol J. 2010; 21(1):5–26.
- Haensch C.A. et al., Diagnostik und Therapie von neurogenen Blasenstörungen. Deutsche Gesellschaft für Neurologie. 2020. S1-Leitlinie, Leitlinien für Diagnostik und Therapie in der Neurologie.
- Stein R. et al., Diagnostik und Therapie der neurogenen Blasenfunktionsstörungen bei Kindern und Jugendlichen mit spinaler Dysraphie. S2k Leitlinie der AWMF. Update 2019.